|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
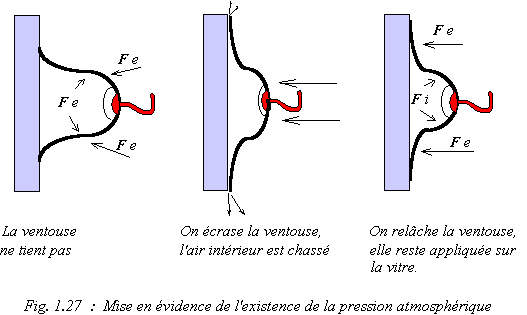
Lorsqu'on applique une ventouse sur une vitre, on chasse l'air qui était sous la ventouse et l'on diminue en même temps la pression.
Ensuite, la ventouse tient par l'action de la force extérieure (Fe) (due à l'air ambiant) qui est bien plus importante que la force intérieure (Fi). La force Fe est développée par la pression atmosphérique, cette pression étant engendrée par le poids de la masse gazeuse entourant la Terre.
|
|
 |
|
|
|
|
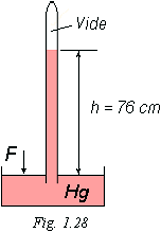
La valeur de la pression atmosphérique peut se mesurer avec le baromètre de TORRICELLI.
Un tube, plein de mercure (Hg), est fermé à une extrémité. On le retourne dans un bac contenant du Hg. La force exercée sur la surface libre dans le bac par la pression atmosphérique empêche le tube de se vider et laisse dans le tube une colonne de mercure de 76 cm de hauteur.
Cette colonne de 76 cm de Hg représente la valeur de la pression atmosphérique normale, c'est-à-dire au niveau de la mer.
|
|
|
En pascals, nous aurons :
ρ du mercure = 13 600 kg/m3
p = γ . h = (13 600 x 9,81) x 0,76 = 101 396 pascals
soit 1,013 bar
Avec : p en pascals ; γ en N/m2 ; h en mètres
|
|
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
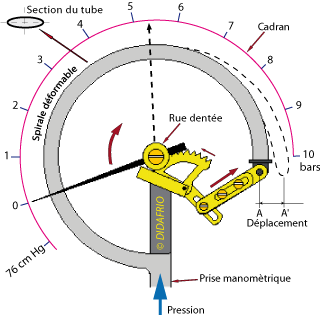
Les manomètres utilisés par les frigoristes sont souvent à tube de Bourdon. Ce dispositif de mesure est basé sur la déformation élastique d'une spirale, formée par un tube plat, sous l’effet d’une pression.
La pression à mesurer agit sur la surface intérieure du tube. L’extrémité non fixée du tube effectue un déplacement qui permet de mesurer la pression.
Pour une augmentation dans la spirale, le point A se déplace en A' ; le secteur denté entraîne la roue dentée et, de ce fait, l'aiguille qui lui est solidaire se déplace sur le cadran.
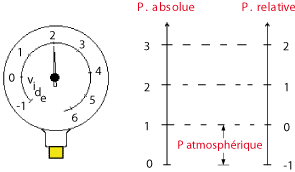
Le zéro du manomètre, utilisé par le frigoriste, correspond à la pression atmosphérique ; dans la pratique, le frigoriste raisonne en tenant compte de la pression relative.
|
|
 |
|
| Fig. 1.29 Manomètre à tube de bourdon. Principe de fonctionnement. |
|
|
|
|
|
|
 |
|
|
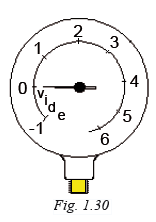
La pression relative se mesure à partir de la pression atmosphérique.
Le diagramme enthalpique d'un fluide frigorigène utilise la pression absolue.
La pression absolue se mesure à partir du vide absolu, c'est-à-dire à partir de l'absence totale de pression.
La pression absolue s'obtient en ajoutant la pression atmosphérique à la pression relative, soit :
|
|
|
Pression absolue = Pression relative + 1,013 bar
|
|
|
|
Exemple :
Le manomètre de la figure 1.31 indique 2 bar ; cette pression relative correspond à 3,013 bar absolus (dans la pratique, on arrondit à 3 bars).
Important :
Lorsqu'on fait des calculs frigorifiques (à partir des pressions mesurées sur une installation), il ne faut surtout pas oublier que les manomètres indiquent une pression relative.
|
|
 |
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
 |
En fait, comme nous venons de le voir, la chaleur est une des formes prises par l'énergie.
Si on ajoute de la chaleur à un corps (c'est-à-dire si nous le chauffons), on obtient une augmentation de sa température. De même, si on enlève de la chaleur à un corps, on provoque un abaissement de sa température.
|
|
La température indique le niveau de chaleur d'un corps.(1)
Pour obtenir une variation de la température d'un corps, nous devrons, selon le but cherché, lui ajouter ou lui retirer de la chaleur. Ceci peut se faire par échange de chaleur avec un autre corps.
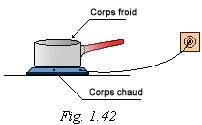
L'échange de chaleur entre deux corps se fait toujours du corps le plus chaud vers le corps le plus froid.
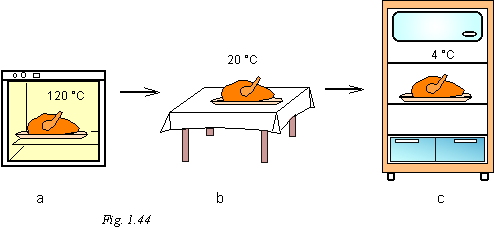
Exemple (Fig. 1.44) :
a) Le poulet que l'on met dans le four va s'échauffer au contact de l'air très chaud du four. Le poulet reçoit de la chaleur.
|
|
|
|
 |
|
|
|
 |
|
|
|
|
b) Le poulet chaud que l'on pose sur une table est au contact de l'air ambiant. Le poulet cède de la chaleur et se refroidit jusqu'à se stabiliser à la température ambiante.
c) Plus tard, on introduit le poulet dans le réfrigérateur, il est alors au contact de l'air à 4 °C. Le poulet cède à nouveau de la chaleur et sa température diminue pour se stabiliser à 4 °C au bout de quelques heures.
On notera que l'échange de chaleur entre deux corps est d'autant plus rapide que leur différence de température est importante. Nous le voyons bien lorsque l'on touche une braise.
|
|
|
 |
|
|
|
|
 |
|
|
|
|
|
|
|
|
 |
|
Sortons une bouteille fraîche du réfrigérateur et posons-la sur une table.
Au bout de quelques instants, on constate que la bouteille est mouillée ; de l’humidité est venue se déposer sur le verre froid de la bouteille.
D’où vient cette humidité ?
C’est la question que l’on peut se poser, mais de nos jours la réponse est bien connue : cette humidité vient tout simplement de l’air.
Effectivement, l’air qui nous entoure, celui que nous respirons, contient bien sûr de l’oxygène, de l’azote et d’autres gaz rares, mais il contient aussi de la vapeur d’eau en suspension.
|
|
La vapeur d’eau ainsi mélangée à l’air est à l’état surchauffé, d’où son caractère invisible, bien que parfois cette humidité devient visible comme c’est le cas en présence de brouillard.
Le dépôt d’humidité :
Les molécules d’eau en suspension dans l’air entourant la bouteille se refroidissent au contact du verre froid et atteignent la température de condensation ; l’eau apparaît et se dépose sur la bouteille qui finit par ruisseler au bout d’un moment.
Cette température à laquelle apparaît la condensation de l’humidité de l’air est appelée « point de rosée ».
Quantité d’humidité :
La quantité de vapeur d’eau contenue en suspension dans l’air est variable : elle peut être très importante dans le cas du brouillard ou très faible, voir nulle, dans le cas de l’air sec.
Ainsi, l’air humide que nous respirons peut contenir entre 0% d’humidité (air sec), et 100% d’humidité à l’apparition du brouillard.
L’état 100 % correspond à l’air saturé, c’est-à-dire que toute vapeur d’eau supplémentaire entraîne le brouillard et la pluie.
La masse d’eau que l’air saturé peut contenir dépend de sa température. Ainsi, l’air saturé à 15 °C contient 13 grammes/mètre cube d’air et l’air saturé à 35 °C contient 42 g/m³ d’air.
Donc, plus la température de l’air sera élevée, plus il aura de capacité à emmagasiner de l’humidité.
La teneur en eau de l’air est aussi appelée humidité absolue (w) et s’exprime en g/kg d’air sec mais on tolère aussi le g/m³.
Entre les deux extrêmes, 0 et 100 %, la masse d’eau en suspension dans l’air peut prendre toutes les proportions imaginables, 10 %, 15 %, 37 %, etc. C’est le degré hygrométrique, plus connu des frigoristes et climaticiens par hygrométrie relative.
L’hygrométrie relative (Hr) est le rapport entre la masse d’eau contenue par l’air considéré et la masse d’eau que ce même air pourrait contenir à saturation.
|
|
|
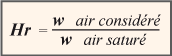 |
|
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
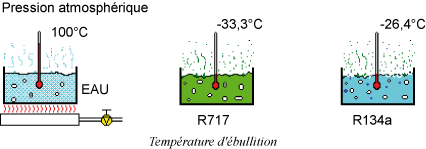
Les fluides frigorigènes ont la particularité d'avoir, sous la pression atmosphérique, une température d'ébullition très faible.
Cette propriété est utilisée pour maintenir l'évaporateur (1) à une température inférieure à celle du milieu à refroidir.
|
|
|
 |
|
|
Exemple :
Si on verse du R134a dans un récipient, il entre immédiatement en ébullition. Si on mesure sa température, on constate : -26,4 °C. C'est le point d'ébullition du R134a sous pression atmosphérique. (Notez qu'il est interdit d'évaporer du R134a à l'air libre).
La même expérience donne –33 °C avec du R717 (NH3) et -47,1 °C avec du R507.
Par contre, l'eau doit être chauffée jusqu'à 100 °C pour obtenir son ébullition sous pression atmosphérique.
(1) - L'évaporateur est un des principaux organes du circuit frigorifique, il sera étudié plus loin.
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
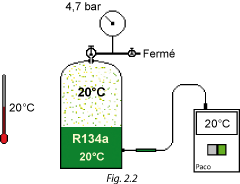
Soit une bouteille de fluide frigorigène contenant du R134a (Fig. 2.2).
Cette bouteille se trouve, depuis quelques heures, dans une ambiance de 20 °C et un thermomètre électronique confirme la même température pour le R134a liquide.
Les vapeurs sont à la même température que le liquide. Ce sont donc des vapeurs saturantes.
A ce moment, la pression relative donnée par le manomètre est de 4,7 bar.
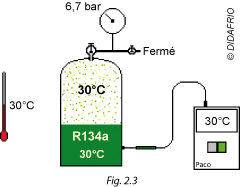
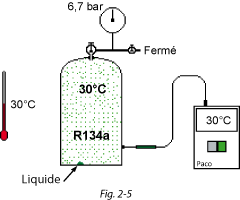
Si on met la bouteille de R134a dans une ambiance où il fait 30 °C, au bout de quelques heures le liquide est également à 30 °C (Fig. 2.3).
Le manomètre indique alors une pression relative de 6,7 bar.
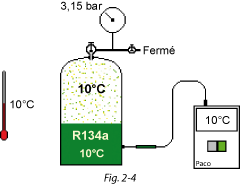
Maintenant, si on refroidit la bouteille à 10 °C, la pression mesurée est de 3,15 bar (Fig. 2.4).
En fait, nous avons affaire ici à un comportement classique des vapeurs saturantes de fluides frigorigènes, la relation PRESSION/TEMPÉRATURE.
A chaque température correspond une pression, et vice-versa.
Une seule condition à cela : il doit y avoir au moins une goutte de liquide dans la bouteille (Fig. 2.5).
En effet, à chaque fois que la température augmente, il se produit une évaporation partielle du fluide. Ceci entraîne une augmentation de la quantité de vapeur au-dessus du liquide, et par conséquent une augmentation de la pression.
Si la température du liquide se stabilise, la pression fait de même et prend une valeur telle qu'elle empêche l'évaporation du liquide.
De la même manière, une diminution de la température du liquide entraîne la condensation d'une partie de la vapeur. De ce fait, celle-ci entraîne une diminution de la pression et crée donc un équilibre à une valeur plus basse.
Cependant, s'il ne reste plus qu'une seule goutte de liquide (et que l'on continue à augmenter la température de la bouteille) une fois cette dernière goutte évaporée, il ne reste plus de liquide pour fournir de la vapeur, et la pression ne peut plus continuer à monter.(1)
Ainsi, la relation pression/température n'est vraie que s'il reste au moins une molécule de liquide.
Chaque fluide a sa relation pression/température.
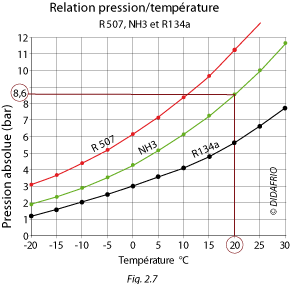
La figure 2.7 montre la relation P/T du R507 et du NH3 (ammoniac) et du R134a.
|
|
 |
|
|
|
 |
|
|
|
 |
|
|
|
 |
|
|
|
 |
|
|
(1) En réalité la pression continue à augmenter, mais très faiblement (environ 0,06b/°C), ce qui est 6 fois inférieur à la montée en pression avec présence de liquide.
|
|
|
 |
|
|
|
(Attention, l'échelle des pressions est graduée en bar absolus).
Exemple : sur le graphique 20 °C donne (pour le NH3), 8,6 bar absolus, c'est-à-dire 7,6 bar au manomètre.
|
|
|
|
 |
|
|
DÉFINITION DU CIRCUIT FRIGORIFIQUE
|
|
|
|
|
|
|
|
 |
|
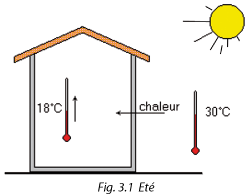
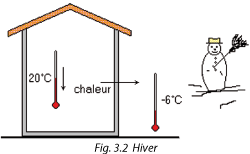
Le quotidien nous démontre que la chaleur se déplace naturellement du chaud vers le froid, c'est-à-dire de l'endroit où la température est élevée vers l'endroit où la température est basse.
Cet échange de chaleur devient nul quand les températures sont identiques.
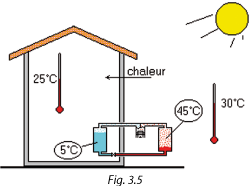
Si on veut qu'en été la température intérieure d'une habitation n'atteigne pas la valeur de la température extérieure (30 °C dans l'exemple), il faut prévoir un système capable d'inverser le flux naturel de la chaleur.
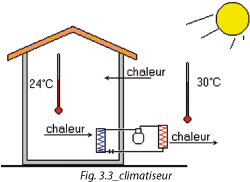
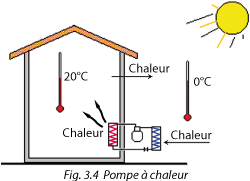
Le circuit frigorifique se définit comme un système qui prend de la chaleur à un endroit où la température est faible (évaporateur) et la transporte pour la rejeter dans un endroit où la température est élevée (condenseur).
Ce principe permet deux types d'applications :
1. Une application de refroidissement (Fig. 3.3)
2. Une application de chauffage (Fig. 3.4)
Un circuit plus élaboré, dit "reversible", peut assurer les deux fonctions.
Le principe du circuit frigorifique consiste à utiliser, dans un circuit fermé, les propriétés thermodynamiques d'un fluide frigorigène.
Nous avons vu, au chapitre 2, que la principale propriété d'un fluide frigorigène est de s'évaporer à une faible tempé-rature sous pression atmosphérique.
Ainsi, nous savons que, sous la pression atmosphérique :
- l'eau bout à 100 °C
- le R134a bout à -26,4 °C
- le R404A bout à -46 °C
- le R717 bout à -33,3 °C
Si la pression exercée sur le liquide augmente, la température d'ébullition fait de même, et inversement. Ainsi, chaque fluide sera caractérisé par une courbe de changement d'état : la relation pression/température.
Dans l'exemple choisi (Figures 3.5 et 3.6), l'air ambiant à 25 °C chauffe le R134a, le fait évaporer à une température de 5 °C et une pression de 2,5 bar.
Le compresseur aspire ces vapeurs, les comprime et les refoule à une pression de 10,6 bar, ce qui permet de les condenser à 45 °C avec de l'air extérieur à 30°C.
|
|
|
|
 |
|
|
|
 |
|
|
|
 |
|
|
|
 |
|
|
|
|
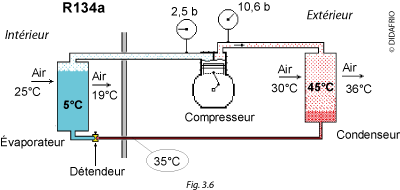 |
La chaleur, dégagée par le fluide lors de sa condensation, a réchauffé l'air de 30 à 36 °C.
Prenons un exemple : le liquide, à la pression de condensation 10,6 bar, arrive au détendeur avec une température de 35 °C.
|
|
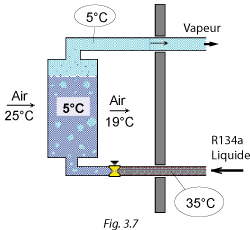
| Aussitôt le détendeur traversé, le liquide (dont la pression vient de chuter à 2,5 bar) s'évapore partiellement et sa température descend à la température d'évaporation de 5 °C.
Pour évaporer le R134a, l'air cède de la chaleur et sa température diminue de 25 à 19 °C.
Ainsi, l'air intérieur est refroidi de 25 à 19 °C, l'air extérieur est réchauffé de 30 à 36 °C, la chaleur absorbée à l'intérieur du local est rejetée à l'extérieur du local.
|
|
|
|
|
 |
|
|
|
|
|
 |
|
|
Quelle est la quantité de chaleur absorbée par le R134a dans l'évaporateur ?
Pour déterminer la quantité de chaleur absorbée dans l'évaporateur, il est nécessaire de connaître :
1) la quantité de chaleur possédée par le liquide arrivant à l'évaporateur,
2) la quantité de chaleur possédée par la vapeur quittant l'évaporateur.
|
|
|
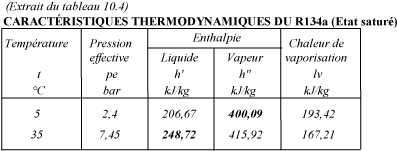
La quantité de chaleur que possède 1 kg de R134a liquide à l'entrée du détendeur correspond à l'ENTHALPIE du liquide à 35 °C.
L'enthalpie peut se lire sur la table du fluide, soit h' = 248,72 kJ/kg.
|
|
|
 |
|
|
|
De même, la table indique l'enthalpie de la vapeur sortant de l'évaporateur :
h" = 409,09 kJ/kg
La différence entre l'enthalpie de la vapeur sortant de l'évaporateur, et celle du liquide traversant le détendeur, donne la quantité de chaleur absorbée par chaque kg de fluide frigorigène passant par l'évaporateur.
|
|
|
|
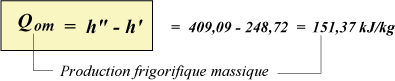 |
|
|
|
|
 |
|
|
Cette chaleur est bien sûr retirée à l'air, ce qui entraîne son refroidissement de 25 à 19 °C.
|
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|